Bài 1: Nêu cách nhận biết: NaCl; HCl; KOH; NaNO3; HNO3; Ba(OH)2
+ mẫu làm quỳ tím hóa xanh là KOH và Ba(OH)2 (1)
+ mẫu làm quỳ tím hóa đỏ là Hcl và HNO3 (2)
+ mẫu không làm quỳ tím đổi màu là NaCl và NaNO3 (3)
+ mẫu xuất hiện kết tủa trắng là Ba(OH)2
+ mẫu xuất hiện kết tủa trắng là Hcl
+ mẫu không hiện tượng là HNO3
+ mẫu xuất hiện kết tủa trắng là NaCl
+ mẫu không hiện tượng là NaNO3
Bài 2: Trong số các dung dịch: HNO3, NaCl, Na2SO4, Ca(OH)2, KHSO4, Mg(NO3)2, dãy gồm các chất đều tác dụng được với dung dịch Ba(HCO3)2 là:
2HNO3 + Ba(HCO3)2→ Ba(NO3)2+ 2CO2+ 2H2O
Na2SO4+ Ba(HCO3)2→ BaSO4+ 2NaHCO3
Ca(OH)2+ Ba(HCO3)2→ CaCO3+ BaCO3+ 2H2O
2KHSO4+ Ba(HCO3)2→ K2SO4+ BaSO4+ 2CO2+ 2H2O
Bài 3: nêu phương pháp nhận biết các lọ đựng riêng biệt các dung dịch mất nhãn: HCl; H2SO4 ;HNO3; H2O Viết các phương trình hoá học xảy ra.
– Dùng giấy quỳ tím, ta nhận biết được HCl, H2SO4, HNO3 làm giấy quỳ chuyển sang màu đỏ. H2O ko làm giấy quỳ chuyển màu.
– Dùng BaCl2 nhận biết được H2SO4 và HNO3 vì pư tạo kết tủa BaSO4 và BaNO3 kết tủa trắng.HCl không pư với BaCl2.
– Để nhận biết H2SO4 và HNO3, dùng AgNO3 để thử. Ta thấy sau pư có kết tủa trắng ít tan của AgSO4 là do H2SO4 pư. Còn HNO3 không pư với AgNO3.
PTHH : H2SO4 + BaCl2 —> BaSO4 + 2HCl
2HNO3 + BaCl2 --> Ba(NO3)2 +2HCl
H2SO4 + 2AgNO3 —-> Ag2SO4 + 2HNO3
Bài 4: Chỉ dùng thêm Cu và một muối tuỳ ý hãy nêu cách nhận biết các hoá chất bị mất nhãn trong các lọ đựng từng chất sau: HCl, HNO3, H2SO4, H3PO4.
Cho Cu vào các mẫu thử ta biết:
+HCl và H3PO4 không xảy ra phản ứng (1)
Bài 5: Trộn 100 ml dung dịch có pH = 1 gồm HCl và HNO3 với 100 ml dung dịch NaOH nồng độ a mol/l thu được 200 ml dung dịch có pH = 12. Giá trị của a là
Bài 6: trộn 3 dung dịch H2SO4 0.1M HCL 0.2 M HNO3 0.3M vs thể thíc bằng nhau dc dung dịch A cho 300ml dung dịch A tác dụng vs V ML DUNG DỊCH b CHỨA naoh 0.2 M và ba(OH)2 0.1M dc dung dịch C có ph =1 giá trị của V = ?
Mỗi dd axit ban đầu có V = 0,3 : 3 = 0,1 l
nH+ = 2nH2SO4 + nHCl + nHNO3 = 2*0,1*0,1 + 0,2*0,1 + 0,3*0,1 = 0,07 mol
⇒ nOH− = nNaOH + 2nBa(OH)2 = 0,4x
Sau phản ứng: nH + = 0,07 − 0,4x
[H+] = 10^−1 = 0,1 M⇒ 0,07 − 0,4x = 0,1*( 0,3 + x )
Bài 7: Trộn các dung dịch HCl 0,75M; HNO3 0,15M; H2SO4 0,3M với các thể tích bằng nhau thì được dung dịch X. Trộn 300 ml dung dịch X với 200 ml dung dịch Ba(OH)2 0,25M thu được m gam kết tủa và dung dịch Y có pH = x. Giá trị của x và m lần lượt là:
VX = 0,3 lit => Vmỗi dd axit = 0,1 lit
=> nH+ = nHCl + nHNO3 + 2nH2SO4 = 0,15 mol ; nSO4 = 0,03 mol
=> nH+ dư = 0,15 – 2.0,05 = 0,05 mol
=> CH+ = 0,05/(0,3 + 0,2) = 0,1M => pH = 1
Lại có : nBaSO4 = nSO4 = 0,03 mol => m = 6,99g
Bài 8: Trung hòa 300ml dung dịch hỗn hợp HCl và HNO3 có pH=2 cần V (ml) dung dịch NaOH 0,02M. Giá trị của V là
Bài 9: hno3 đặc nguội không tác dụng với kim loại nào
Bài 10: hno3 loãng không tác dụng với kim loại nào
Axit nitric tác dụng với hầu hết các kim loại (trừ Au và Pt).
Bài 11: ứng dụng nào không phải của hno3
Sản xuất khí NO2 và N2H4 không phải ứng dụng của HNO3
Bài 12: Khi cho kim loại tác dụng với HNO3 thì không thể tạo ra hợp chất
Bài 13: số oxi hoá của nito trong hno3
HNO3: 1 + X + 3x (-2) = 0 ⇒ X = 5 ⇒ số oxi hóa của N trong HNO3 là +5
Trong phân tử HNO3 nguyên tử N có : a. hoá trị V, số oxi hoá +5.
Bài 14: Trộn 200 ml dd hỗn hợp gồm HNO3 0,3M và HClO4 0,5M với 200 ml dd Ba(OH)2 a mol/lit thu được dd có pH = 3. Vậy a có giá trị là:
Ta có: ∑nH+ = 0,2( 0,3 + 0,5)= 0,16mol; nOH-= 0,4.a
Sau khi phản ứng xảy ra dung dịch thu được có pH= 3 chứng tỏ axit dư.
[H+] sau phản ứng = (0,16-0,4a)/ 0,4 = 10^-3Bài 15: hno3 làm quỳ tím chuyển màu gì
Tương tự các axit mạnh khác, dung dịch axit nitric có thể làm quỳ tím chuyển sang màu đỏ.
Bài 16: Cho HNO3 đậm đặc vào than nung đỏ, khí thoát ra là
Bài 17: Đối với dung dịch axit mạnh HNO3 0,1M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
[H+] = 0.1MBài 18: Dung dịch HNO3 0,1M có pH bằng
[H+] = 0,1M => pH = – log[H+] = – log[0,1] = 1Bài 19: Dung dịch HNO3 0,01M có giá trị pH là
HNO3 là chất điện li mạnh, điện li hoàn toàn thành ion: HNO3 → H+ + NO3−
Bài 20: Dùng 340,1 kg xenlulozơ và 420 kg HNO3 nguyên chất có thể thu được bao nhiêu tấn xenlulozơ trinitrat, biết sự hao hụt trong quá trình sản xuất là 20%?
công thức tính nhanh số mol hno3
công thức kim loại tác dụng với hno3
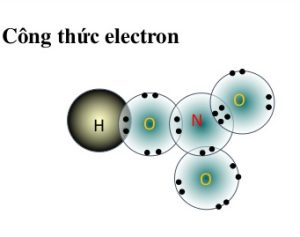
công thức cấu tạo của hno3: HNO3
công thức electron của hno3 là
công thức tính nhanh số mol hno3
nHNO3 = (số e trao đổi + số nguyên tử N trong sản phẩm khử)*nsản phẩm khử
công thức kim loại tác dụng với hno3
M + 2nHNO3 → M(NO3)n + nNO2 + nH2O
3M + 4nHNO3 → 3M(NO3)n + nNO + 2nH2O
M + HNO3 → M(NO3)n + (NO2; NO; N2O; N2; NH4NO3) + H2O
Bài 22: Cho 2,16 gam Mg tác dụng với dung dịch HNO3 (dư). Sau khi phản ứng xảy ra hoàn toàn thu được 0,896 lít khí NO (đktc) và dung dịch X. Khối lượng muối khan thu được khi làm bay hơi dung dịch X là
Bảo toàn electron : 2nMg = 3nNO + 8nNH4NO3
m muối khan = m Mg(NO3)2 + m NH4NO3 = 13,92g
Axit nitric là một trong những axit mạnh nhất
Bài 24: hno3 thể hiện tính axit mạnh khi tác dụng với
CuO , NaOH , MgCO 3 , Fe 2 O 3 CuO, NaOH, MgCO3, Fe2O3
Bài 25: gốc axit của axit hno3 hóa trị mấy
Bài 26: cách pha loãng axit hno3
C=(10*C%*d)/Đ, với Đ là số đương lượng, sau đó bạn áp dụng định luật đương lượng để tính V của acid đậm đặc : C1V1=C2V2, C2 và V2 là nồng độ đương lượng và thể tích lúc sau bạn cần pha loãng ra, C1 và V1 là nồng độ đương lượng và thể tích của acid đậm đặc
Bài 27: Nhóm các kim loại đều không phản ứng được với HNO3?
Bài 28: bài toán kim loại tác dụng với hno3 như sau: Hỗn hợp X chứa 0,03 mol Cu; 0,03 mol Zn; 0,03 mol Mg và 0,02 mol Al. Cho toàn bộ lượng X trên tác dụng hết với dung dịch HNO3 (đặc, nóng) thu được sản phẩm khử duy nhất là khí NO2 và dung dịch sau phản ứng chứa m gam muối. Giá trị của m là:
ne = 0.03* (2+2+2) + 0.02*3 = 0.24 -> n NO3- = 0.24
-> m = 0.03*(64+65+24) + 0.02*27 + 0.24*62 = 20.01
Bài 29: dãy kim loại tác dụng với hno3 đặc nguội
Kim loại tác dụng được với dung dịch HNO3 đặc nguội là Mg, Cu, Ag, Zn, Ca.
Bài 30: Cho sắt dư vào dung dịch HNO3 loãng thu được
Bài 31: Cho sắt phản ứng với dung dịch HNO3 đặc, nóng thu được một chất khí màu nâu đỏ, chất khí đó là
Bài 32: cộng hóa trị của n trong hno3
cộng hoá trị 5, số oxi hoá +4.
Bài 33: các sản phẩm khử của hno3
Sản phẩm khử của HNO3 không phải H2 mà là các sản phẩm khử khác của Nitơ như: NO2 (nếu là HNO3 đặc), NO, N2O, N2, NH4NO3 (nếu là HNO3 loãng)
Bài 34: hno3 có tính khử không
HNO3 (Axit nitric) có tính khử ở một số chất nhất định. Sản phẩm khử của HNO3 (Axit nitric) là tùy thuộc vào độ mạnh của kim loại và nồng độ của dung dịch axit, thông thường thì:
Dung dịch HNO3 đặc tác dụng với kim loại → NO2;
Dung dịch HNO3 loãng tác dụng với kim loại khử yếu (như: Cu, Pb, Ag,..) → NO;
Dung dịch HNO3 loãng tác dụng với kim loại mạnh (như: Al, Mg, Zn,…) thì N bị khử xuống mức càng sâu → (N2, N2O, NH4NO3).
Bài 35: cách tính số mol hno3 bị khử
nHNO3 = 4nNO + 2nNO2 + 10n N2O + 12nN2 + 10nNH4NO3
Bài 36: Cho 5 lít dung dịch HNO3 68% (D = 1,4 g/ml) phản ứng với xenlulozơ dư thu được m kg thuốc súng không khói(xenlulozơ trinitrat), biết hiệu suất phản ứng đạt 90%. Giá trị m gần nhất là
Bài 37: hno3 là chất gì, hno3 tên gọi là gì
Axit nitric là hợp chất vô cơ có công thức hóa học HNO3. Hno3 là chất ô nhiễm thứ cấp
Sử dụng axit nitric để sản xuất các chất hữu cơ, bột màu, sơn, thuốc nhuộm vải và thuốc tẩy màu.
Dùng làm chất tẩy rửa các đường ống, bề mặt kim loại trong các nhà máy sữa.
Sử dụng trong sản xuất phân bón, được sử dụng chủ yếu để sản xuất phân đạm, các muối nitrate ngành phân bón như KNO3, Ca(NO3)2,…
Bài 39: Hướng dẫn sử dụng bảo toàn e hno3
Trong một số bài toán ta phải chú ý biện luận trường hợp tạo ra các sản phẩm khác: NH4NO3 dựa theo phương pháp bảo toàn e (nếu ne cho > ne nhận để tạo khí) hoặc dựa theo dữ kiện đề bài (chẳng hạn cho dung dịch NaOH vào dung dịch sau phản ứng thấy có khí thoát ra) hoặc các hợp chất khí của Nitơ dựa vào tỉ khối hơi của hỗn hợp đã cho. Xem thêm: https://hoahoc247.com/bai-tap-kho-ve-a2013.html#ixzz7go8XAuIy
Bài 40: Cho amin đơn chức X tác dụng với HNO3 loãng thu được muối amoni Y trong đó nitơ chiếm 22,95% về khối lượng. Vậy công thức phân tử của amin là
Số mol H N O 3 cần dùng để hòa tan hõn hợp kim loại được tính theo công thức sau:
n HNO3 = 4n NO + 2n NO2 + 10n N2O + 12n N2 + 10n NH4NO3
Bài 42: dung dịch hno3 để lâu thường ngả sang màu nâu là vì sao ?
HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường ngả sang màu vàng là do dung dịch HNO3 bị phân hủy 1 phần tạo thành một lượng nhỏ NO2.
Bài 43: trong phân tử hno3 có các loại liên kết là liên kết gì ?
phối trí (cho – nhận) và cộng hoá trị
Tag: ba oh 100ml 2m 75m 15m kl td 200ml bai tap ve 10m 1kg ctct lewis 16g g minh dạng thụ động oxit xác 68 đọc ngoài