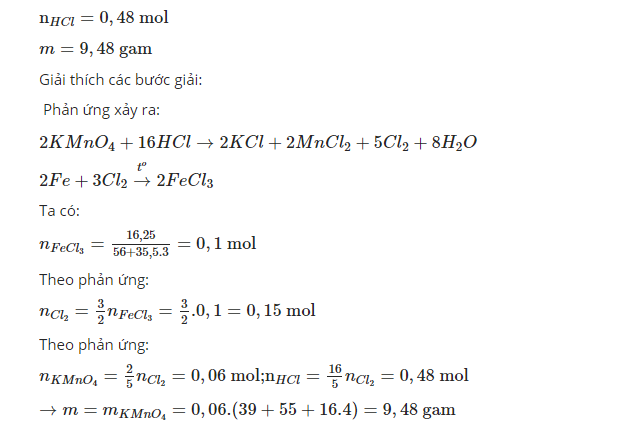Bài 1: Hoà tan m gam Fe trong dung dịch HCl dư, sau khi phản ứng kết thúc thu được 6,72 lít khí H2 (đktc). Giá trị của m là
Bài 2 Cho 11,2 g Fe tác dụng vs dung dịch HCl. Tính thể tích khí H2 thu được ở (đktc)
Bài 3 Cho m gam KMnO4 tác dụng hết với dd hcl(đặc) dư, toàn bộ khí clo sinh ra tác dụng với hết với Fe dư, thu được 16,25 gam FeCl3 tính số mol Hcl và giá trị m
Bài 4 Trung hòa dd KOH 2M bằng 250ml HCl 1.5M.
a) Tính thể tích dd KOH cần dùng cho ới
b) Tính nồng độ mol của dd muối thu được sau pứ
c) Nếu thay dung dịch KOH bằng dung dịch NaOH 10% thì cần phải lấy bao nhiêu gam dung dịch NaOH để Trung Hoà hết lượng oxit trên
a) Ta có: nHCl=0,25.1,5=0,375 mol
Theo ptpu: nKOH=nHCl=0,375 mol ->V KOH=0,375/2=0,1875 lít
b) muối thu được là KCl ->nKCl=nHCl=0,375 mol
V dung dịch =0,25+0,1875=0,4375 lít
Ta có : nNaOH=nHCl=0,375 mol ->mNaOH=0,375.40=15 gam
-> m dung dịch NaOH=15/10%=150 gam
Bài 5 Cho 15,00 gam glyxin vào 300 ml dung dịch HCl, thu được dung dịch X. Cho X tác dụng vừa đủ với 250ml dung dịch KOH 2M, thu được dung dịch Y. Cô cạn Y, thu được m gam chất rắn khan. Giá trị của m là
Coi dung dịch X thành hỗn hợp Glyxin : 0,2 mol và HCl : x mol
X + KOH : KOH + H2NCH2COOH → H2NCH2COOK + H2O
→ x = 0,5 – 0,2 = 0,3 → mmuối = 44,95
Bài 6 Nhận biết HCl, H2SO4, HNO3
Mỗi chất lấy 1 lượng nhỏ cho vào các lọ ,đánh số
– Cho các chất t/d với dd BaCl2
+ Chất nào xuất hiện kết tủa trắng là H2SO4
PTHH : BaCl2 + H2SO4 →→ BaSO4 ↓↓ + 2HCl
+ Chất nào không xuất hiện kết tủa là HNO3 , HCl
– Cho 2 dd còn lại qua dd AgNO3
+ Chất nào xuất hiện kết tủa trắng là HCl
PTHH : HCl + AgNO3 →→ HNO3 + AgCl
+ Chất nào không xuất hiện kết tủa là HNO3
Bài 7 Cho 10,44g MnO2 tác dụng với axit HCL đặc .Khí sinh ra [đktc] cho tác dụng vừa đủ với V lit dd NaOH 2M
a) tính thể tích khí sinh ra (đktc)
b) tính Vdd NaOH và Cm các chất trong dd thu được
Bài 8 Tính khối lượng HCl bị oxi hóa bởi MnO2 là bao nhiêu, biết rằng khí Cl2 sinh ra trong phản ứng đó có thể đẩy được 12,7g I2 từ dung dịch NaI
Phương trình hóa học của phản ứng
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
Khối lượng HCl cần dùng là: mHCl = 0,2 x 36,5 = 7,3g
Bài 9 Phản ứng nào sau đây chứng tỏ HCl có tính khử ? Viết phương trình chứng minh hcl có tính khử
Phản ứng chứng tỏ HCl có tính khử là phản ứng trong đó số oxi hóa của Cl tăng.
MnO2 + HCl → MnCl2 + Cl2 + H2O.
Bài 10 Giá trị pH của dung dịch HCl 0,01M là
Bài 11 Nhúng 2 đũa thủy tinh vào 2 bình đựng dung dịch HCl đặc và NH3 đặc. Sau đó đưa 2 đũa lại gần nhau thì thấy xuất hiện
Nhúng 2 đũa thủy tinh vào 2 bình đựng dung dịch HCl đặc và NH3 đặc. Sau đó đưa 2 đũa lại gần nhau thì thấy xuất hiện khói màu trắng
Nguyên nhân là do HCl đặc phản ứng với NH3 đặc tạo thành khói trắng NH4Cl
Bài 12 Chất nào sau đây tác dụng được với dung dịch HCl?
Bài 13 hcl là axit mạnh hay yếu
Bài 15 những chất không tác dụng với hcl ? kim loại không tác dụng với hcl ?
Các kim loại đứng phía sau hydro trong dãy điện hóa như Cu, Au, Ag,…
Muối không tan: những muối có gốc CO3 hay PO4 (trừ K2CO3, Na2CO3, K3PO4, Na3PO4)
Nó không tác dụng với tất cả các axit, phi kim, oxit kim loại và oxit phi kim
Bài 16 tại sao cu không tác dụng với hcl
Vì kim loại đồng đứng sau nguyên tố Hidro trong dãy hoạt động hóa học của kim loại nên không tác dụng với dung dịch H C l loãng mà có thể tác dụng với Axit đặc
Bài 17 Cho 9 (gam) etylamin tác dụng vừa đủ với axit HCl. Khối lượng muối thu được là
nC2H5NH2 = 9/(29+16) = 0,2 mol ⇒ nHCl = 0,2 mol.
mmuối = mC2H5NH2 + mHCl = 9 + 0,2.36,5 = 16,3 gam.
Bài 18 những kim loại tác dụng với hcl
Những kim loại tác dụng với HCl là các kim loại đứng trước Hidro trong bảng tuần hoàn như Fe, Al, Mg.
Bài 19 Kim loại M phản ứng được với các dung dịch HCl, Cu(NO3)2, HNO3 (đặc, nguội). M là kim loại nào dưới đây
Bài 20 Trộn 100 ml dung dịch có pH = 1 gồm HCl và HNO3 với 100 ml dung dịch NaOH nồng độ a mol/l thu được 200 ml dung dịch có pH = 12. Giá trị của a là
Dung dịch axit ban đầu có [H+] = 0,1 M
Dung dịch sau phản ứng có pH = 12
⇒ dư bazơ và có pOH =14 – 12 = 2
n H + phản ứng = n O H − phản ứng = 0,01 mol
⇒ nNaOH ban đầu = n O H − phản ứng + n O H − dư
Bài 21 dãy các oxit tác dụng được với dung dịch hcl
Bài 22 nhôm tác dụng với hcl, kẽm tác dụng với hcl, đồng có tác dụng với hcl không
Cu + HCl không xảy ra phản ứng
Bài 23 công thức electron của hcl
Bài 24 công thức cấu tạo của hcl
Bài 25 hcl có dẫn điện không, tại sao hcl trong benzen không dẫn điện
Dung dịch HCl trong nước chứa các ion H+ và Cl– (do sự phân li của các phân tử HCl) chuyển động tự do, nên dẫn điện.
Dung dịch HCl trong benzen không chứa các ion, vì các phân tử HCl trong dung môi này không phân li ra ion được, nên không dẫn điện.
liên kết cộng hoá trị phân cực.
Tag: tac voi dich kmn04 15g 300ml h3po4 biệt ba nguội cách pt 001m xác định 001 ko etyl amin 9g tượng 100ml nhóm aaxit technologies tên gọi ty