I) Kim loại tác dụng axit nitric
Kim loại tác dụng với dung dịch axit HNO3 giải phóng hỗn hợp nhiều sản phẩm.
Bước 1: Nếu tạo ra hỗn hợp khí, thiết lập biểu thức tính M trung bình của hh từ đó rút ra tỉ lệ số mol (hay tỉ lệ thể tích) giữa các khí sản phẩm.
Bước 2: Viết phương trình cho nhận electron của các chất oxi hóa khử.
Bước 3: Sử dụng bảo toàn electron tìm số mol các chất chưa biết.
Bước 4: Tính toán theo yêu cầu bài toán.
Ví dụ bài tập hỗn hợp kim loại tác dụng với hno3
Hòa tan hỗn hợp gồm 0,1 mol Al và 0,2 mol Zn bằng 500 ml dd HNO3 vừa đủ, thu được dd A và không thấy khí thoát ra. Cô cạn dd A thu m gam muối.Giá trị của m:
Sản phẩm khử là NH4NO3 ⇒ nNH4NO3 = (0,1.3 + 0,2.2)/8 = 0,7/8 mol
m = mAl(NO3)3 + mZn(NO3)2 + mNH4NO3 = 0,1.213 + 0,2.189 + (0,7/8).80 = 66,1 gam
II) Oxit, bazo tác dụng axit nitric
– Sử dụng phương pháp quy đổi hỗn hợp các oxit kim loại về nguyên tố đơn giản.
– Sử dụng kết hợp với bảo toàn electron và bảo toan nguyên tố để giải toán
+ Đối với oxit sắt: nếu trong một hỗn hợp nFeO = nFe2O3 thì coi hỗn hợp FeO, Fe2O3 là Fe3O4
+ Nếu một bài toán có nhiều quá trình oxi hóa khử chúng ta chỉ cần để ý đến số oxi hóa của nguyên tố đó trước và sau phản ứng, sau đó dùng định luật bảo toàn e áp dụng chung cho cả bài toán.
Xem thêm link bài tập hay và khó về axit nitric
https://123docz.net/document/677392-bai-tap-ve-hno3-va-muoi-nitrat-05.htm
Câu 1 : Axit nitric và axit photphoric cùng phản ứng với nhóm các chất sau:
Câu 2: Thể tích của dung dịch axit nitric 63% (D = 1,4 g/ml) cần vừa đủ để sản xuất được 59,4 kg xenlulozơ trinitrat (hiệu suất 80%) là
nHNO3 = 3 nxenlulozotrinitrat / 0,8= 0,75
V = (0.75*63)/(0.63*1.4) = 53.57
Câu 3 Thể tích dung dịch HNO3 67,5% (khối lượng riêng là 1,5 gam/ml) cần dùng để tác dụng với xenlulozơ tạo thành 89,1 kg xenlulozơ trinitrat là (biết lượng HNO3 bị hao hụt là 20%) :
Câu 4: Thể tích dung dịch HNO3 1M loãng ít nhất cần dùng để hòa tan hoàn toàn một hỗn hợp gồm 0,15 mol Fe và 0,15 mol Cu là: (Biết phản ứng tạo chất khử duy nhất là NO):
Câu 5: Tính thể tích dung dịch HNO3 96% (D = 1,53 g/ml) cần dùng để tác dụng với lượng dư xenlulozơ tạo 29,7 gam xenlulozơ trinitrat.
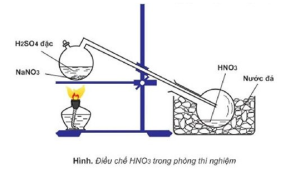
Câu 6: Cho sơ đồ điều chế HNO3 trong phòng thí nghiệm
Phát biểu nào sau đây là sai khi nói về quá trình điều chế HNO3?
HNO3 là axit yếu hơn H2SO4 nên bị đẩy ra khỏi muối.
Câu 7: Cho sơ đồ phản ứng : Fe3O4 + HNO3 → Fe(NO3)3 + NxOy + H2O. Sau khi cân bằng, hệ số của phân tử HNO3 là :
Câu 8: sơ đồ điều chế hno3 trong công nghiệp như thế nào
Câu 9: Cho sơ đồ phản ứng sau: Mg + HNO3 → Mg(NO3)2 + N2O↑ + H2O. Nếu hệ số cân bằng trong phương trình của Mg là 4 thì hệ số cân bằng của HNO3 là
4Mg + 10HNO3 → 4Mg(NO3)2 + N2O + 5H2O
Câu 10: Cho sơ đồ phản ứng : Al + HNO3 → Al(NO3)3 + N2 + N2O + H2O
Biết khi cân bằng tỉ lệ số mol giữa N2O và N2 là 3 : 2. Tỉ lệ mol nAl : nN2O : nN2 lần lượt là
Câu 11: Axit nitric tinh khiết, không màu để ngoài ánh sáng lâu ngày sẽ chuyển thành
Axit nitric tinh khiết không màu để ngoài ánh sáng lâu ngày sẽ chuyển dần sang màu vàng là do: axit HNO3 không bền nên bị phân hủy một phần thành NO2 làm cho axit có màu vàng.
4HNO3 → O2 + 2H2O + 4NO2↑ (màu nâu đỏ)
Câu 12: Hoà tan hoàn toàn m gam Al vào dung dịch HNO3 rất loãng thì thu được hỗn hợp gồm 0,015 mol khí N2O và 0,01mol khí NO (phản ứng không tạo NH4NO3). Giá trị của m là:
Câu 13: Hòa tan 4,59 gam Al bằng dung dịch HNO3 thu được hỗn hợp khí NO và N2O (sản phẩm khử duy nhất) có tỉ khối hơi đối với hiđro bằng 16,75. Thể tích NO và N2O thu được ờ đktc là:
Câu 14: Cho 4,05 gam Al tan hết trong dung dịch H N O 3 thu V lít N 2 O (đkc) là sản phẩm khử duy nhất. Giá trị V là
n Al = 0.15 mol; n Al*3 = n H2O*8
Câu 15: Cho 0,8 mol nhôm tác dụng với dung dịch HNO3 thu được 0,3 mol khí X (không có sản phẩm khử nào khác). Khí X là :
xN+(5x-2y)e————>xN(số mol NxOy bằng 0,3 mol)
⇒ 0,24 = (5x – 2y)0,3=> y=(5x-8)/2 khi x=1 và x=2
Câu 16: Cho 11g hỗn hợp gồm Al và Fe vào dung dịch HNO3 dư được 6,72lít NO đktc là sản phẩm khử duy nhất .Khối lượng của Al và Fe lần lượt là:
Áp dụng định luật bảo toàn e có: 3nAl + 3nFe = 3 nNO
m hỗn hợp = 11g ⇒ 27a + 56b = 11 (2)
Từ (1),(2) ⇒ a = 0,2 ; b = 0,1
Tag: đều hcl 63 đ 96 d 52g ít lỏng chuyên đề luyện nâng cao thi đại học lời violet lớp hoá bai tap ve lop albumin g chemical name đậm đặc