Câu 1: Hãy viết 1 số phương trình nổi bật của H2SO4
2AlCl3 + 3H2SO4 → Al2(SO4)3 + 6HCl
6KMnO4 + 10AlCl3 + 24H2SO4 → 5Al2(SO4)3 + 3K2SO4 + 6MnSO4 + 24H2O + 15Cl2
Al2S3 + 3H2SO4 → Al2(SO4)3 + 3H2S
6 H2SO4 + Al4C3 → 2 Al2(SO4)3 + 3 CH4
10 Fe3O4 + 2 KMnO4 + 48 H2SO4 → 15 Fe2(SO4)3 + 2 MnSO4 + K2SO4 + 48 H2O
6KMnO4 + 10FeCl3 + 24H2SO4 → 3K2SO4 + 6MnSO4 + 5Fe2(SO4)3 + 15Cl2 + 24H2O
8H2SO4 + 2KMnO4 + 10FeSO4 → 5Fe2(SO4)3 + 8H2O + 2MnSO4 + 1K2SO4
5Fe + 8H2SO4 + 2KMnO4 → 5FeSO4 + 2MnSO4 + K2SO4 + 8H2O
2CuFeS2 + 18H2SO4 → 2CuSO4 + Fe2(SO4)3 + 17SO2 + 18H2O
6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + 2NO + 4H2O
FeS + 12HNO3 → 9NO2 + Fe(NO3)3 + 5H2O + H2SO4
2K2CrO7 + 18FeSO4 + 14H2SO4 → Cr2(SO4)3 + 2K2SO4 + 9Fe2(SO4)3 + 14H2O
3FeS2 + 26HNO3 → 3Fe(NO3)3 + 6H2SO4 + 17NO + 7H2O
Cu(NO3)2 + H2SO4 → CuSO4 + 2HNO3
Khi cho cu tác dụng với h2so4 loãng và nano3
3Cu + 4H2SO4 + 8NaNO3 → 3Cu(NO3)2 + 4H2O + 4Na2SO4 + 2NO
3Cu + 2KNO3 + 4H2SO4 → 3CuSO4 + 2NO + K2SO4 + 4H2O
CuCO3 + H2SO4 → CuSO4 + H2O + CO2
6H2SO4 + Cu2S ⟶ 6H2O + 5SO2 + 2CuSO4
Cu2O + 3H2SO4 → 2CuSO4 + 3H2O + SO2
2KMnO4 + 5Na2SO3 + 3H2SO4 → K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O
3Na2SO3 + K2Cr2O7 + 4H2SO4 → 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O
H2SO4 + MgSO3 → MgSO4 + H2O + SO2
Mg(NO3)2 + H2SO4 → MgSO4 + 2HNO3
Câu 2: axit sunfuric đặc có thể làm khô các khí
Axit sunfuric đặc được sử dụng làm khô các chất khí ẩm. Loại khí có thể được làm khô nhờ axit sunfuric đặc là khí không tác dụng được với H2SO4 đặc
H2SO4 đặc để làm khô CO2, N2, SO2, O2.
Câu 3: không dùng axit sunfuric đặc để làm khô khí
Do phản ứng: H2S + H2SO4 → S + 2H2O + SO2
Câu 4: nhận biết axit sunfuric và muối sunfat
Để nhận biết axit sunfuric và dung dịch muối sunfat, ta dùng thuốc thử là dung dịch muối như BaCl2, Ba(NO3)2 … hoặc dùng Ba(OH)2. Phản ứng tạo thành kết tủa trắng BaSO4 không tan trong nước và trong axit.
Câu 5: lưu huỳnh tác dụng với axit sunfuric đặc nóng
S là chất khử, H2SO4 là chất oxi hóa
=> tỉ lệ số nguyên tử lưu huỳnh bị khử : số nguyên tử lưu huỳnh bị oxi hóa là 2 : 1
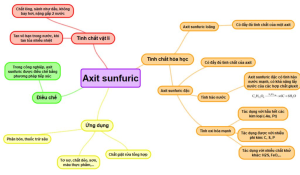
Câu 6: sơ đồ tư duy axit sunfuric
Câu 7: sơ đồ sản xuất axit sunfuric trong công nghiệp
Câu 8: chất không tác dụng với axit sunfuric đặc nguội là
Al, Cr, Fe thụ động hóa trong H2SO4 đặc nguội
Câu 9: Tại sao al không tác dụng với h2so4 đặc nguội
Vì tạo lớp màng oxit bền vững bao bọc xung quanh bề mặt kim loại ngăn không cho phản ứng xảy ra
Câu 10: cu có tác dụng với h2so4 đặc nguội không
Cu tác dụng với H2SO4 đặc nóng hoặc đặc nguội tạo thành muối đồng(II) sunfat, giải phóng khí SO2 và tạo thành nước
Câu 11: zn có tác dụng với h2so4 đặc nguội không
Câu 12: Cho dung dịch axit sunfuric loãng tác dụng với muối natrisunfit (Na2SO3). Chất khí nào sinh ra ?
H2SO4 + Na2SO3 → Na2SO4 + SO2 ↑ + H2O
=> chất khí sinh ra là SO2: lưu huỳnh đioxit
Câu 13: Dãy muối tác dụng với dung dịch axit sunfuric loãng là:
Câu 14: nhôm oxit + axit sunfuric
Al2O3 + 3H2SO4 → Al2(SO4) + 3H2O
Câu 15 : nhôm tác dụng với axit sunfuric
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Câu 16: axit sunfuric loãng là gì, axit sunfuric loãng tác dụng được với dãy chất nào
Axit sunfuric loãng là một axit mạnh với đầy đủ các tính chất hóa học chung của một axit
Câu 17: thí nghiệm tính háo nước của axit sunfuric đặc
Axit sunfuric H2SO4 là một chất lỏng không màu, không mùi và sánh lỏng, tan vô hạn trong nước. Nó có khối lượng riêng là 1,84 g/cm3, nhiệt độ nóng chảy là 10°C, nhiệt độ sôi là 338 °C Axit sunfuric đặc có đặc tính háo nước và tỏa nhiều nhiệt nên khi pha loãng phải cho từ từ axit đặc vào nước mà không làm ngược lại, vì H2SO4 có thể gây bỏng nặng. Vì có đặc tính háo nước axit sunfuric còn có khả năng hút nước, làm than hóa các hợp chất hữu cơ. Tính chất hóa học của axit sunfuric.
Câu 18: h2so4 có tan trong nước không
Câu 19: đổ h2so4 vào nước và ngược lại
Khi axit sunfuric gặp nước thì lập tức sẽ có phản ứng hóa học xảy ra, đồng thời sẽ tỏa ra một nhiệt lượng lớn. Axit sunfuric đặc giống như dầu và nặng hơn trong nước. Nếu bạn cho nước vào axit, nước sẽ nổi trên bề mặt axit. Khi xảy ra phản ứng hóa học, nước sôi mãnh liệt và bắn tung tóe gây nguy hiểm
Câu 20: axit sunfuric đặc tác dụng với kim loại
H2SO4 đặc phản ứng được với hầu hết các kim loại (trừ Au và Pt)
Câu 21: axit sunfuric loãng tác dụng với kim loại nào, kim loại nào không tác dụng với h2so4 loãng
Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat
Câu 22: bài tập kim loại tác dụng với h2so4 đặc nóng
https://vietjack.com/hoa-hoc-lop-12/bai-tap-kim-loai-tac-dung-voi-h2so4-dac-nong.jsp
Câu 23: cho 5,4g Al vào 100ml dd H2SO4 0,5M . Thể tích khí H2 sinh ra(ở đktc) và nồng độ mol của dd sau pư là bao nhiêu?( giả sử thể tích dd thay đổi không đáng kể)
PTHH: 2Al+3H2SO4=>Al2(SO4)3+3H2
p/ư: 1/30<-0,05—>1/60——-->0,05
=> CM(Al2(SO4)3)=1/60:0,1=1/6M
Câu 24: Những hiđro halogenua có thể thu được khi cho H2SO4 đặc lần lượt tác dụng với các muối NaF, NaCl, NaBr, NaI là
Câu 25: Có 5 lọ hoá chất khác nhau, mỗi lọ chứa một dung dịch của một trong các hoá chất sau: NaOH, HCl, H2SO4, BaCl2, Na2SO4. Chỉ được dùng thêm phenolphtalein (các điều kiện và dụng cụ thí nghiệm có đủ), hãy trình bày phương pháp hoá học nhận biết 5 hoá chất trên và viết phương trình hoá học xảy ra
Lấy một lượng vừa đủ mỗi mẫu hoá chất cho vào các ống nghiệm rồi đánh số thứ tự. Nhỏ từ từ dd phenolphtalein vào các ống nghiệm chứa các hoá chất nêu trên.
+ Ống nghiệm nào có màu hồng đó là dd NaOH; không màu là một trong các dd H2SO4, HCl, BaCl2, Na2SO4.
+ Cho dd màu hồng vào 4 ống nghiệm còn lại, có hiện tượng mất màu hồng là dung dịch H2SO4, HCl ( nhóm I), không có hiện tượng gì là dd BaCl2, Na2SO4 (nhóm II).
2NaOH + H2SO4 → Na2SO4 + 2H2O.
–Nhỏ lần lượt các dd ở nhóm 1 vào các dd ở nhóm 2:
+ Nếu không có hiện tượng gì thì dd đem nhỏ là dd HCl, dd còn lại của nhóm I là H2SO4.
+ Nếu khi nhỏ dd ở nhóm 1 vào nhóm 2 thấy 1 dd xuất hiện kết tủa trắng, 1 dd không có hiện tượng gì thì dd đem nhỏ ở nhóm 1 là H2SO4, dd còn lại là HCl; còn dd ở nhóm 2 tạo kết tủa là BaCl2; dd không tạo kết tủa ở nhóm 2 là Na2SO4.
Tag: đây bằng – 33 cách vẽ về pt chứng minh thích ko x alcl3 ionic equation al2 so4 fecl3 fe2 fe2so43 овр cufes2 feso4 hno3 no3 no2 no k2cro7 n2ox n2o cuno32 cuno3 kno3 cu2s+h2so4 cr2 mg mgno3 hidro phân biệt