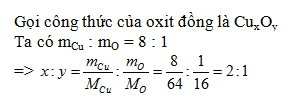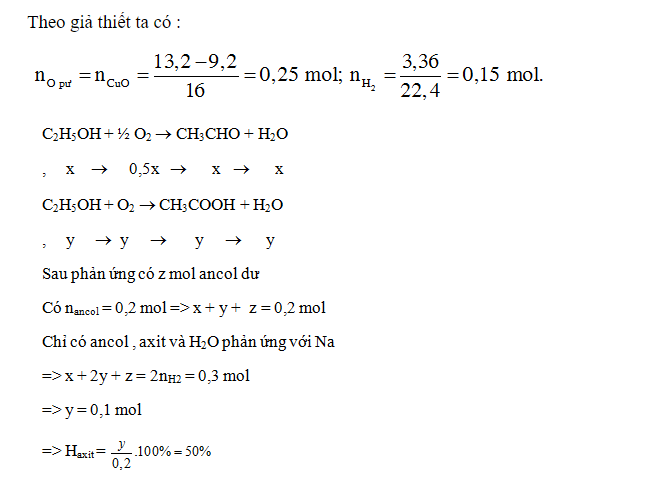Bài 1: Đồng(II) oxit (CuO) tác dụng được với
axit, sản phẩm là muối và nước.
Bài 2: Một loại đồng oxit có thành phần gồm 8 phần khối lượng đồng và 1 phần khối lượng oxi. Công thức của oxít đó là
Bài 3: Khử 8g đồng(II) oxit bằng khí hidro
b. Tính khối lượng kim loại thu được
a) Phương trình hóa học cho phản ứng khử đồng(II) oxit (CuO) bằng khí hidro (H2) là:
b) Tính khối lượng kim loại thu được:
Đầu tiên, ta cần tìm số mol của 8g đồng(II) oxit: Khối lượng phân tử của CuO = 63.5 (Cu) + 16 (O) = 79.5 g/mol
Số mol CuO = (8 g) / (79.5 g/mol) ≈ 0.1006 mol
Theo phương trình hóa học, tỷ lệ mol giữa CuO và Cu là 1:1. Do đó, số mol Cu thu được cũng là 0.1006 mol.
Tiếp theo, ta tính khối lượng Cu thu được: Khối lượng phân tử của Cu = 63.5 g/mol Khối lượng Cu = (0.1006 mol) × (63.5 g/mol) ≈ 6.38 g
Vậy, khối lượng kim loại đồng (Cu) thu được là 6.38 g.
Bài 4: Cho 1,6 gam đồng (II) oxit tác dụng với 100 gam dung dịch axit sunfuric có nồng độ 20%.
a) Viết phương trình phản ứng hóa học.
b) Tính nồng độ phần trăm các chất có trong dung dịch sau khi phản ứng kết thúc.
a) Viết phương trình phản ứng hóa học:
Phương trình hóa học cho phản ứng của đồng(II) oxit (CuO) với axit sunfuric (H2SO4) là:
b) Tính nồng độ phần trăm các chất có trong dung dịch sau khi phản ứng kết thúc:
Đầu tiên, ta cần tính số mol của CuO và H2SO4.
- Khối lượng phân tử của CuO = 63.5 (Cu) + 16 (O) = 79.5 g/mol
- Số mol CuO = (1.6 g) / (79.5 g/mol) ≈ 0.0201 mol
- Nồng độ phần trăm của dung dịch H2SO4 là 20%, tức là trong 100 g dung dịch có 20 g H2SO4.
- Khối lượng phân tử của H2SO4 = 2 (H) + 32 (S) + 4×16 (O) = 98 g/mol
- Số mol H2SO4 = (20 g) / (98 g/mol) ≈ 0.2041 mol
Do số mol H2SO4 lớn hơn số mol CuO, nên CuO là chất giới hạn. Khi phản ứng kết thúc, hết CuO và một phần H2SO4 sẽ phản ứng.
- Khối lượng CuSO4 thu được = số mol CuO × khối lượng phân tử CuSO4 = 0.0201 mol × 159.5 g/mol ≈ 3.2 g
- Số mol H2SO4 còn lại = 0.2041 mol – 0.0201 mol = 0.184 mol
- Khối lượng H2SO4 còn lại = 0.184 mol × 98 g/mol ≈ 18 g
- Tổng khối lượng sau phản ứng = khối lượng CuSO4 + khối lượng H2SO4 còn lại + khối lượng nước = 3.2 g + 18 g + 80 g = 101.2 g
- Nồng độ phần trăm CuSO4 = (khối lượng CuSO4 / tổng khối lượng dung dịch) × 100% = (3.2 g / 101.2 g) × 100% ≈ 3.16%
- Nồng độ phần trăm H2SO4 = (khối lượng H2SO4 còn lại / tổng khối lượng dung dịch)
Bài 5: Oxi hoá ancol đơn chức X bằng CuO (đun nóng),sinh ra một sản phẩm hữu cơ duy nhất là xeton Y (tỉ khối hơi của Y so với khí hiđro bằng 29). Công thức cấu tạo của X là
Bài 6: Oxi hoá 9,2 gam ancol etylic bằng CuO đun nóng thu được 13,2 gam hỗn hợp gồm anđehit, axit, ancol dư và nước. Hỗn hợp này tác dụng với Na sinh ra 3,36 lít H2 (ở đktc). Phần trăm khối lượng ancol đã chuyển hóa thành axit là :
Bài 7: Phần trăm khối lượng của Cu trong CuO là
%mCu = 64 / (64+16) * 100 = 80%
Bài 8: Cho 0,2 mol CuO tác dụng vừa đủ với dung dịch H2SO4 20% đun nóng, sau đó làm nguội dung dịch đến 10oC. Tính khối lượng tinh thể CuSO4.5H2O đã tách ra khỏi dung dịch, biết rằng độ tan của CuSO4 ở 10oC là 17,4 gam.
Tính khối lượng CuSO4 thu được từ 0,2 mol CuO:
Khối lượng phân tử của CuSO4 = 63.5 (Cu) + 32 (S) + 4×16 (O) = 159.5 g/mol
Khối lượng CuSO4 = 0.2 mol × 159.5 g/mol = 31.9 g
Tính khối lượng dung dịch H2SO4 20% cần dùng:
Trong dung dịch H2SO4 20%, có 20% là H2SO4 và 80% là nước. Vì vậy, 1 g dung dịch chứa 0.2 g H2SO4 và 0.8 g nước.
Do tỷ lệ mol giữa CuO và H2SO4 là 1:1, số mol H2SO4 cần dùng cũng là 0,2 mol.
Khối lượng phân tử của H2SO4 = 2 (H) + 32 (S) + 4×16 (O) = 98 g/mol
Khối lượng H2SO4 cần dùng = 0.2 mol × 98 g/mol = 19.6 g
Khối lượng dung dịch H2SO4 20% cần dùng = 19.6 g / 0.2 = 98 g
Tính khối lượng nước trong dung dịch sau phản ứng:
Sau phản ứng, khối lượng nước trong dung dịch = 0.8 × 98 g = 78.4 g
Tính khối lượng CuSO4 có thể hòa tan ở 10oC:
Độ tan của CuSO4 ở 10oC là 17,4 g/100 g nước.
Khối lượng CuSO4 có thể hòa tan = 17,4 g/100 g × 78.4 g ≈ 13.64 g
Tính khối lượng CuSO4 không hòa tan và tách ra dưới dạng tinh thể CuSO4.5H2O:
Khối lượng CuSO4 không hòa tan = 31.9 g – 13.64 g = 18.26 g
Tính khối lượng tinh thể CuSO4.5H2O tách ra:
Khối lượng phân tử của CuSO4.5H2O = 159.5 (CuSO4) + 5×18 (5H2O) = 159.5 + 90 = 249.5 g/mol
Tỉ lệ mol giữa CuSO4 và CuSO4.5H2O là 1:1, vì vậy số mol CuSO4.5H2O tương ứng với 18.26 g CuSO4 là 18.26 g / 159.5 g/mol ≈ 0.1144 mol.
Khối lượng tinh thể CuSO4.5H2O = số mol CuSO4.5H2O × khối lượng phân tử CuSO4.5H2O = 0.1144 mol × 249.5 g/mol ≈ 28.54 g
Vậy, khối lượng tinh thể CuSO4.5H2O đã tách ra khỏi dung dịch là 28.54 g.
Bài 9: Cho 32g CuO tác dụng vừa đủ với H2SO4 thu được CuSO4 và H2O. Tìm khối lượng của H2SO4
PTHH: CuO + H2SO4 —-> CuSO4 + H2O
Theo PTHH ta có: nH2SO4=nCuO=0,4mol
Bài 10: Cho 28 gam hỗn hợp X gồm Fe, Fe3O4, CuO vào dung dịch HCl, thu được 3,2 gam một kim loại không tan, dung dịch Y chứa muối và 1,12 lít khí H2 (đktc). Cho Y vào dung dịch AgNO3 dư, thu được 132,85 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Khối lượng Fe3O4 trong X là
Bài 11: Hỗn hợp X gồm Cu, CuO, Fe, Fe3O4. Hòa tan hết m gam X trong dung dịch chứa 0,775 mol HCl (dư 25% so với lượng phản ứng), thu được 0,06 mol H2 và 250 gam dung dịch Y. Mặt khác, hòa tan hết m gam X trong dung dịch H2SO4 đặc nóng, thu được dung dịch Z (chứa 3 chất tan) và 0,09 mol SO2 (sản phẩm khử duy nhất của H2SO4). Cho Z tác dụng với dung dịch Ba(OH)2 dư, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 103,22 gam chất rắn. Nồng độ phần trăm FeCl3 trong Y là
Bài 12: Để khử hoàn toàn 30 gam hỗn hợp gồm CuO, FeO, Fe3O4, Fe2O3,Fe, MgO cần dùng 5,6 lít khí CO (đktc). Khối lượng chất rắn thu được sau phản ứng là :
Áp dụng định luật bảo toàn khối lượng ta có : 30 + mCO = m + mCO2 → m = 30 + 0,25 x 28 – 0,25 x 44 = 26 (g)
Bài 13: Khi hòa tan 30g hỗn hợp Cu và CuO trong dung dịch HNO3 1M (dư), thoát ra 6,72 lit khí NO (đktc). Khối lượng của CuO trong hỗn hợp ban đầu là
Bảo toàn ne=> 2nCu = 3nNO => nCu = 0,45 => mCuO = 30 – mCu = 1,2g
Bài 14: Liệt kê 1 số phương trình tiêu biểu sau:
13O2 + 4CuFeS2 → 4CuO + 2Fe2O3 + 8SO2
Đồng(II) oxit (CuO) không tác dụng với ancol nói chung.
Đồng(II) oxit (CuO) không tác dụng với ancol etylic (C2H5OH).
Đồng(II) oxit (CuO) không tác dụng với ancol benzylic (C6H5CH2OH).
Al + CuO → Al2O3 + Cu Khi đun nóng, nhôm (Al) có thể khử đồng(II) oxit (CuO) tạo thành nhôm oxit (Al2O3) và kim loại đồng (Cu).
Đồng(II) oxit (CuO) không tác dụng với ancol propylic (C3H7OH).
Đồng(II) oxit (CuO) không tác dụng với ancol isopropylic (iso-C3H7OH).
Cuo cộng gì ra cuso4, cuo tác dụng với dung dịch h2so4 tạo thành
CuO + H2SO4 → CuSO4 + H2O Đồng(II) oxit (CuO) tác dụng với axit sunfuric (H2SO4) tạo thành sulfat đồng(II) (CuSO4) và nước (H2O).
Để chuyển CuO thành CuSO4, bạn cần cho CuO tác dụng với axit sunfuric (H2SO4) theo phương trình đã đề cập ở trên.
Để chuyển CuSO4 thành CuO, bạn cần cho CuSO4 tác dụng với dung dịch kiềm như NaOH, sau đó đốt nhiệt chất rắn thu được: CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4 Cu(OH)2 → CuO + H2O (đốt nhiệt)
Đồng(II) oxit (CuO) không tác dụng trực tiếp để tạo ra nitơ (N2).
CuO + SO3 → CuSO4 Đồng(II) oxit (CuO) có thể tác dụng với lưu huỳnh trioxit (SO3) tạo thành sulfat đồng(II) (CuSO4).
Để chuyển CuS thành CuO, bạn cần xử lý CuS trong không khí (O2) ở nhiệt độ cao: 2CuS + 3O2 → 2CuO + 2SO2
CuO không tác dụng trực tiếp với nước ở điều kiện bình thường. Tuy nhiên, nếu bạn cho CuO tác dụng với dung dịch kiềm như NaOH, CuO sẽ tạo thành muối và nước:
6g bị bởi ko al+ o2 so4 loãng td 28g cufes2